1.
Napisz wyrażenie określające adiabatyczne rozprężanie promieniowania:
![]()
Jeśli
ciśnienie promieniowania jest opisane związkiem: p= (1/3) – ε to: T3V = const
2.
Sformułuj aksjomat bilansowy dla wielkości ekstensywnej.
Aksjomat bilansowy głosi, iż zmiana zasobu wielkości
ekstensywnej zmagazynowanej w układzie bilansowania może być dokonana tylko
bądź za przyczyną produkcji zasobu WE wewnątrz układu bilansowania, bądź za
przyczyną wymiany zasobu wielkości ekstensywnej poprzez granice układu
bilansowania lub w wyniku jednoczesnego przebiegu obu tych procesów.
3.
Zdefiniuj pojęcie ciśnienia dynamicznego w poruszającym się płynie:

4.
Pojemnością cieplną lub ciepłem właściwym substancji, które ozn. literą C,
nazywamy iloraz elementarnego przyrostu masowej gęstości
zasobu ciepła do elementarnego przyrostu temperatury bezwzględnej wywołanej
przyrostem tego ciepła.
![]() ,
,
dla gazu doskonałego
CJ ,Cp=
const.
5.
Wyrażenie określające ciśnienie gazu działającego na powierzchnię padania.
Ciśnienie parcjalne na powierzchni AB: pi =Fi/AB
Przyrost ciśnienia cząstek poruszających się z prędkością Vi
w kierunku powierzchni padania pod kątem θ:
dpi=2mVi2cos2θdn lub dpi=nimVi2sinθdθ

6.
Zdefiniuj pojęcie wielkości ekstensywnej i podaj przykłady:
Wielkością
ekstensywną (WE)nazywamy wielkość geometryczną lub fizyczną, której zasób w
obszarze złożonym z sumy podobszarów równy jest sumie zasobów we wszystkich
podobszarach. Przykłady wielkości wektorowych WE : pęd, kręt.
Przykłady
wielkości skalarnych WE: objętość, masa, energia, entropia.
7.
Podaj zasadę ekwipartycji energii.
Rozdział energii pomiędzy stopnie swobody tak, aby średnia
energia przypadająca na każdy stopień swobody była jednakowa, nazywamy zasadą
ekwipartycji energii.
8.
Opisz zjawisko emisji wymuszonej.
Zjawisko emisji wymuszonej polega na jednoczesnym
spadku wszystkich atomów znajdujących się na wyższym poziomie energetycznym na
niższy poziom energetyczny. Towarzyszy temu duża ilość fotonów emitowanych o
energii: hν = 2Ei tworząc
spójne promieniowanie monochromatyczne o dużych gęstościach zasobu strumienia
emisji energii.
9.
Podaj klasyfikację energii układu.
Całkowita energia układu jest równa sumie energii ruchu
wszystkich cząstek substancji wypełniających układ, czyli energii kinetycznej
szeroko rozumianej oraz pól siłowych w obszarze układu, czyli energii
potencjalnej szeroko rozumianej.
10. Klasyfikacja energii
wewnętrznej:
•
En. ruchu postępowego i obrotowego drobin
•
En. ruchu drgającego atomów w drobinach,
•
En. potencjalna w polu wzajemnego, przyciągania drobin,
•
En. chemiczna z możliwością przebudowy drobin,
•
En. stanów elektronowych,
•
En. jądrowa.
11.
Zdefiniuj pojecie entropii i wymień inne znane ci parametry stanu gazu.
Entropia jest to zjawisko samorzutnego dochodzenia układów
nie równoważonych termodynamicznie w procesach nieodwracalnych do stanu
równowagi termodynamicznej.
12.
Klasyfikacja transportu energii:
• poprzez wymianę ciepła,
• poprzez wymianę pracy,
• poprzez wymianę masy.
13.
Zdefiniuj pojęcie entropii.
Entropia jest równa iloczynowi stałej Boltzmana i
logarytmu gęstości prawdopodobieństwa wystąpienia stanu układu.
Ze statystycznego punktu widzenia największemu
stopniu nie uporządkowania układu przyporządkowane jest największe
prawdopodobieństwo wystąpienia tego stanu. Inne parametry stanu: temp.
ciśnienie. Entropia izolowanego układu osiąga wartość max dla wart. zmiennej
losowej X równej x odpowiadającej stanowi równowagi układu. Entropia układu
złożonego z „n” słabo oddziaływujących na siebie podukładów równa jest sumie
entropii tych podukładów.
14.
Wyrażenie na masową gęstość zasobu entropii dla gazu doskonałego.
W
funkcji temp. i masowej gęstości zasobu objętości:
![]()
W
funkcji temperatury i ciśnienia:
![]()
15.
Współczynnik eustynuncji:
αλ – współczynnik absorbcji
objętości
βα - współczynnik rozproszenia objętości
![]()
16.
Podział zasobu energii promieniowania:
Oznaczając
zasób energii absorbowanej A, pochłoniętej P, zaś reflektowanej R, można
zapisać bilans energii promieniowania padającego na ciało:
A+P+R=Q
a = A/Q – zdolność absorbcyjna
p = P/Q – zdolność przepuszczania
r = R/Q – zdolność refleksyjna

17.
Wymień założenia przyjęte dla modelu gazu doskonałego.
-cząstki gazu mają rozmiar punktów materialnych,
-objętość zajmowana przez cząsteczki gazu jest pomijalnie
mała,
-cząsteczki gazu wykazują cechy doskonale sprężystych kulek
znajdujących sie w ciągłym chaotycznym ruchu prowadzącym do zderzeń miedzy sobą
i ściankami naczynia; miedzy cząsteczkami gazu nie występują inne oddziaływania
poza sprężystymi zderzeniami,
-bezpośrednią miarą temperatury jest średnia energia
kinetyczna jego cząstek.
18.
Określ masową gęstość zasobu ciepła dla przemiany izotermicznej:
Dla
przemiany izotermicznej masowa gęstość zasobu ciepła = pracy bezwzględnej =
pracy technicznej.

19.
Odwracalnością termodynamiczną względem procesu termodynamicznego:
nazywamy
taki stan, w którym proces termodynamiczny występujący w układzie jest w
równowadze termodynamicznej, jednakże pod wpływem zadziałania elementarnego
bodźca termodynamicznego przybiera kierunek przebiegu zawsze zgodny z
kierunkiem zadziałania elementarnego bodźca termodynamicznego (zmiana kierunku
zadziałania bodźca termodynamicznego powoduje zmianę kierunku przebiegu procesu
termodynamicznego).
20.
Praca internijna maszyny roboczej.
Jest to część pracy wykonanej wewnątrz układu ograniczonego
osłoną poprowadzona wzdłuż ścian wewnętrznych maszyny, która jest przekazywana
na zewnątrz układu.
Li = Lin + Lf
Lin – praca indykatorowa równa
wykresowej,
Lf – praca tarcia wewnątrz
maszyny.
21.
Praca odwracalnego przebiegu prawo i lewobrzeżnego:
Dla prawo: Lob = Lex – Lk
Dla lewo: Lobl = Lk – Lex
Gdzie: Lex – praca ekspansji
Lk
– praca kompresji
Dla nieodwracalnego:
Lobn = (Lex –
Lk) – (Lfex + Lfk)
Lobnl
= (Lk – Lex) – (Lfex + Lfk)
22.
Średnia prędkość kwadratów prędkości cząsteczek w gazie doskonałym.
Średnia
kwadratów prędkości cząsteczek w gazie doskonałym może być określona z
definicji w skali temperatury T, tak aby:
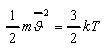 czyli
czyli 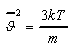
Stąd
średnia kwadratu prędkości cząstek określona jest zależnością : 
Średnia
prędkość cząstek definiowana jest przez:

23. W przemianie
izotermicznej
masowa gęstość zasobu ciepła, praca techniczna są sobie równe:
![]()
wartość
masowych gęstości zasobu ciepła wymienionego w przemianie izotermicznej
dqT
= Tdr = pdV = -V2dp
24.
Punkt krytyczny K:
Odpowiada stanowi krytycznemu, w
którym objętościowe gęstości zasobu masy dwóch faz są jednakowe a przy zmianie
stanu skupienia nie pojawia się powierzchnia podziału faz.
Przemiany termodynamiczne
25.
Przemiana izochoryczna

26.
Przemiana izobaryczna.
27.
Przemiana izotermiczna.

28.
Napisz wyrażenie określające funkcję rozkładu widmowego objętościowej gęstości
zasobu ilości oscylatorów w polu długości fal pudła izotermicznego:

29.
Napisz wyrażenie określające funkcję rozkładu widmowego objętościowej gęstości
zasobu ilości oscylatorów w polu.

30.
Sprawność internijna (wewnętrzna)
Nazywamy stosunek pracy (mocy)
internijnej do pracy (mocy) obiegu porównawczego hi=Li/Lob=Ni/Nob
31.
Sprawność efektywna
Nazywamy stosunek pracy (mocy)
efektywnej do pracy (mocy) obiegu porównawczego he=Le/Lob=hm*hi
32.
Sprawność termiczna
Nazywamy stosunek masowej
gęstości zasobu pracy internijnej do wartości opałowej paliwa ht=Li/Wu
33.
Sprawność termiczna obiegu porównawczego
Nazywamy stosunek pracy obiegu
porównawczego do ciepła dostarczonego do obiegu hob.=Lob/Qd
34.
Podaj definicję stopnia suchości pary mokrej.
x=mp/(mc+mp) – jest udziałem masowym pary suchej nasyconej w mieszaninie
cieczy i pary. Stopień suchości pary mokrej jest drugim, po ciśnieniu
parametrem charakteryzującym stan pary mokrej.
Stopień suchości x może przyjmować wartości w zakresie od x=0, kiedy mp=0 i
mamy do czynienia tylko z cieczą wrzącą, do x=1 kiedy mc=0 i mamy do czynienia tylko z
para suchą nasyconą.
35. Zdefiniuj pojęcie
wilgotności bezwzględnej gazu wilgotnego:
Wilgotność
bezwzględna jest objętościową gęstością zasobu masy pary dla ciśnienia
składnikowego dla pary ρp:

Max.
wartość wilgotności bezwzgl. występuje wtedy, gdy ciśnienie pary jest równe
ciśnieniu nasycenia dla danej temperatury:

36.
Podaj zerową zasadę termodynamiki.
Jeżeli dwa układy nie graniczące ze sobą znajdują się w
równowadze cieplnej z trzecim układem, z którym graniczą, to są one również w
równowadze cieplnej między sobą.
37.
I zasada termodynamiki
W odosobnionym układzie, tj. w
układzie ciał który jest otoczony osłoną adiabatyczną wykluczającą jakąkolwiek
wymianę energii z otoczeniem, całkowita energia w nim zawarta jest wielkością
niezmienną. W układzie takim może zachodzić wzajemna przemiana jednego rodzaju
energii w drugi, ale suma tych energii nie zmienia się.
38.
I zasada termodynamiki dla ukł. otwartego:
Redukuje ona bilans zasobu energii wewnętrznej dla układu
otwartego do warunków procesu termodynamicznie odwracalnego czyli do procesu
termodynamicznego przebiegającego w warunkach równowagi termodynamicznej bez
tarcia. Zatem zasada ta jest opisana równaniem:
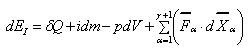
Jeżeli na układ bilansowania nie działają siły zewnętrzne
to otrzymamy:
![]()
39. II zasada termodynamiki (Classiusa)
Żadna pracująca cyklicznie maszyna
nie może, bez jakichś dodatkowych efektów, przenosić w sposób ciągły ciepła z
jednego ciała do drugiego, mającego wyższą temperaturę.
40.
II zasada termodynamiki (Kelvina (i Plancka))
Niemożliwa jest przemiana, której
jedynym wynikiem byłaby zamiana na pracę ciepła pobranego ze źródła mającego
wszędzie tę samą temperaturę.
41.
Sformułuj II zasadę termodynamiki dla przemian nieodwracalnych:
W
procesie nieodwracalnym iloczyn temp. bezwzględnej układu i elementarnego
zasobu przyrostu entropii, równy jest sumie elementarnego przyrostu zasobu
ciepła wymienionego między układem a otoczeniem, powiększonej o elementarny
przyrost zasobu ciepła tarcia wykreowanego w układzie:
Tds = δQ + δQf
42.
II zasada termodynamiki dla przemian odwracalnych.
W układzie nieadiabatycznym w procesie odwracalnym iloczyn
temp. bezwzględnej T i elementarnego przyrostu zasobu entropii dS równy jest
elementarnemu przyrostowi zasobu ciepła δQ wymienionego między układem a
otoczeniem.
TdS = δQ.
W przemianach rzeczywistych nieodwracalnych przemianie
termodynamicznej może towarzyszyć rozpraszanie energii w procesie tarcia, które
jest równoważne kreacji zasobu ciepła Qf.
dS = (dQ + dQf)/T
43.
Napisz wnioski wynikające z II zas. termod.
Nie istnieje maszyna cieplna
pracująca cyklicznie, wykonująca pracę bez zmian w otoczeniu: ds = dQ/T
44.
III zasada termodynamiki.
W pobliżu temperatury zera bezwzględnego suma entropii ciał
reagujących przed reakcją jest taka sama jak po reakcji, tzn. że przyrost
entropii związany z reakcją chemiczną zdąża do zera, czyli że w pobliżu
temperatury T=0oK entropia produktów reakcji jest równa entropii
ciał wejściowych (substratów).
45.
Sformułuj III zasadę termodynamiki dla przemian odwracalnych.
W układzie nie adiabatycznym w procesie odwracalnym iloczyn
temperatury bezwzględnej układu i elementarnego przyrostu zasobu entropii,
równy jest elementarnemu przyrostowi zasobu ciepła wymienionego między układem
a otoczeniem. TdS=δQ
46.
Podaj prawo Avogadra, wyjaśnij co określa liczba Avogadra.
W jednakowych objętościach znajduje się taka sama liczba
cząstek tego samego gazu doskonałego jeśli ciśnienia i temperatury tych gazów
są jednakowe: m1=n1•M1,m2=n2•M2
; n – liczba cząstek gazu; M – masa cząsteczkowa; m – masa;
MR=B –
uniwersalna stała gazowa.
Liczba Avogadra określa ilość cząstek zawartych w jednym
molu dowolnej substancji. NA=6,023•1023[1/mol]
47.
Wyjaśnij i zapisz prawo izochory Charles’a.
V,m = const , a = 1/β =
273,15[K]
 ,
, ![]()
![]() ,
, ![]()
p
= p0(1+β0t)
48.
Równanie stanu gazu doskonałego Clapeyrona
Dokonując syntezy praw Boyle’a –
Mariotta z prawem Gay – Lussaca dochodzi się do równania:
pV=MRT
49.
Wyjaśnij prawo Daltona dla formy gazowej wieloskładnikowej
Ciśnienie
całkowite „p” fazy gazowej wieloskładnikowej badanej mieszaniny gazów
doskonałych, równoważne jest ciśnieniu jakie wywierałby gaz doskonały
jednoskładnikowy mający następujące parametry stanu:
•
temperaturę T równą temp. fazy gazowej wieloskładnikowej,
•
objętościową gęstość zasobu ilości moli ρa równą sumie
objętościowych gęstości zasobu ilości moli składników mieszaniny ρni
![]()
50.
Napisz wyrażenie definiujące temperaturę Debey'a
θ=hVp/k
51.
Wyjaśnij i zapisz zjawisko Joule’a – GayLussaca:
Opisuje
ono dławienie adiabatyczno – izoenergetyczne gazu doskonałego. Podczas
dławienia gazu następuje produkcja entropii jako, że jest to proces
nieodwracalny i w stanie wyrównania ciśnień entropia układu osiąga max.
dS = δqf/T =pdJ/T
Dla
gazu doskonałego energia kinetyczna przemieszczenia substancjalnego cząsteczek
po wyhamowaniu ich prędkości substancjalnej do zera równoważna energii
cieplnej, równa jest co do wartości pracy bezwzględnej: dqf=pdJ
52.
Wyjaśnij i zapisz prawo Gay-Lussaca:
Gazy rzeczywiste zbliżają swe wartości do gazu doskonałego
wówczas gdy ciśnienie gazu maleje a temp. wzrasta i jest wysoka w porównaniu z
temp. nasycenia
 ,
, ![]()

53.
Podaj regułę faz Gibbsa:
p – liczba różnych faz,
c –
liczba różnych składników,
f –
liczba stopni swobody układu.
Reguła
faz Gibbsa wskazuje, że dla zachowania równowagi powinien być spełniony
warunek: f
=c–p+2
Liczba
stopni swobody to liczba takich parametrów jak: ciśnienie, temperatura i
koncentracja składników układu, które mogą się zmieniać nie powodując
naruszenia równowagi układu.
54.
Napisz wyrażenie określające średnią energię oscylatora Plancka dla cząsteczki:

55. Prawo promieniowania Stefana
Strumień wymiany ilości cząstek odniesiony do jednostki
powierzchni lub wymiana ilości cząstek przez jednostkę powierzchni w jednostce
czasu, określany jest zależnością: n=nJ/4; n – objętościowa gęstość zasobu ilości
cząstek gazu, J -
prędkość średnia cząstek gazu. Natomiast przez analogię strumienia wymiany
zasobu ilości fotonów określona jest zależnością nf=nc/4
RT=sT4
56. Podaj prawo przesunięcia Viena.
λmT=hc/(k•4,965)=δw=2,898•10-3
Odwrotnie
proporcjonalna zależność długości fal λm od temp. T opisuje ilościowo
mechanizm przesuwania się maksimum rozkładu widmowego objętościowej gęstości
zasobu energii promieniowania elektromagnetycznego ελ(λ) w miarę
wzrostu temperatury w stronę fal krótszych.
57.
Typowy wykres fazowy we współrzędnych (T,p) dla metalu:

Ttr – temp. punktu potrójnego
Tk – temp. punktu krytycznego
 równ. Clausiusa - Clapeyrona
równ. Clausiusa - Clapeyrona